در سال ۲۰۲۵ بازسازی مو با سلولهای بنیادی از مرحله آزمایشگاهی عبور کرده و به فناوریهای عملی نزدیک شده است. روشهایی مانند مهندسی فولیکول، ارگانوئیدهای مو و بازسازی نیچ سهبعدی درمان طاسی را از «تقویت فولیکولهای باقیمانده» به سمت «تولید فولیکولهای جدید» سوق دادهاند. ترکیب سلولهای بنیادی با PRP، SVF و داربستهای زیستی نیز در مطالعات معتبر موجب افزایش رشد، تراکم و بازسازی طبیعی فولیکولها شده است.
در این مقاله، به بررسی پیشرفتهترین و اثربخشترین فناوریهای بازسازی مو با سلولهای بنیادی در سال ۲۰۲۵ میپردازیم و نگاهی به آیندهای میاندازیم که در آن درمان طاسی دیگر محدود به پیوند سنتی نیست، بلکه تولید و مهندسی فولیکولهای مو به یک واقعیت قابل دسترس تبدیل شده است.
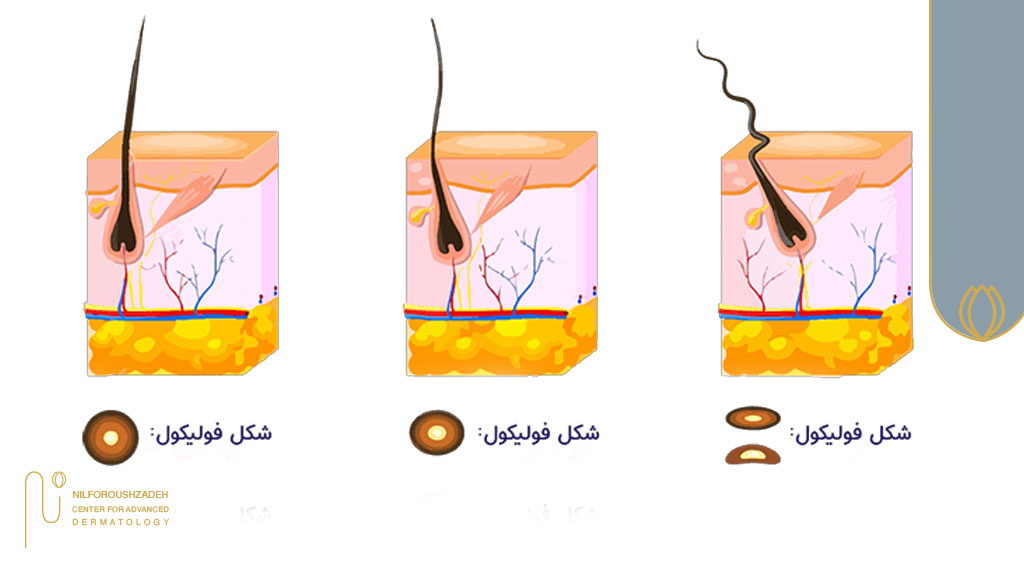
ساختار فولیکول مو
فولیکول مو یک «ارگان کوچک» (mini-organ) است که برخلاف تصور عمومی، فقط یک منفذ یا لایه ساده زیر پوست نیست؛ بلکه سیستمی پیچیده از چندین بخش فعال زیستی دارد. هر فولیکول، از دو بخش اصلی تشکیل شده است:
- بخش مزانشیمی (مانند سلولهای پاپیلای درمی، DPC) که حکم فرمانده مولکولی و تغذیهای فولیکول را دارد،
- بخش اپیتلیالی (سلولهای بنیادی اپیتلیال) که سازنده لایههای مختلف ساقه موست.
اما آنچه مهم است این است که تنها «تعادل و گفتوگوی دائمی» بین این دو بخش است که به شکلگیری یک فولیکول سالم و رشد طبیعی مو میانجامد. این پدیده با نام تعامل اپیتلیال–مزانشیمی (epithelial–mesenchymal interaction یا EMI) شناخته میشود و اساس تولد و حیات هر تار موست.
چرا این تعامل اپیتلیالی–مزانشیمی برای بازسازی واقعی مو مهم است؟
برای احیای موهای از دست رفته به روشهای نوین یعنی ساخت فولیکولهای جدید از پایه، نه صرفاً تقویت باقیماندهها باید بتوانیم «محیط اطراف فولیکول یا nich فولیکول» را بازسازی کنیم؛ محیط سهبعدی منحصربهفردی که بستر رشد و ارتباط سلولهای اپیتلیالی و مزانشیمی را فراهم میسازد.
در این میکرو محیط ویژه اطراف فولیکول، باید المانهایی مانند ساختار سه بعدی، ماتریکس خارجسلولی (ECM)، سلولهای مزانشیمی و اپیتلیالی و سیگنالهای حیاتی (مثل Wnt و BMP) در هماهنگی کامل باشند تا فرایند فولیکولسازی موفق باشد.
در سال ۲۰۲۵، بسیاری از فناوریهای بازسازی مو از ارگانوئیدهای آزمایشگاهی تا روشهای مهندسی ECM دقیقاً بر پایه همین درک عمیق از میکرومحیط فولیکول و تعامل EMI توسعه یافتهاند تا آینده درمان طاسی را متحول کنند
فناوریهای ۲۰۲۵ با روشهای قدیمی کاشت مو تفاوت اساسی دارند؟
- رویکرد درمانی سنتی:
انتقال فولیکول از بانک مو به ناحیه دچار ریزش (Transplantation)، بدون ساخت فولیکول جدید؛ صرفاً جابهجایی واحدهای موجود. - رویکرد بازسازی مو در ۲۰۲۵:
هدف اصلی، ساخت و مهندسی فولیکول جدید است؛ از طریق مهندسی نیچ فولیکولی، بازسازی EMI (تعامل اپیتلیال–مزانشیمی)، فعالسازی مسیرهای Wnt و BMP و استفاده از سلولهای بنیادی، ارگانوئیدها و داربستهای ECM. - نتیجه:
فناوریهای ۲۰۲۵ یک تغییر الگو ایجاد کردهاند؛ از درمانهای کمکی برای تقویت فولیکولهای موجود، به سمت فولیکولسازی (Hair Follicle Neogenesis) و بازسازی واقعی مو.
جدول مقایسه درمانهای سنتی vs فناوریهای ۲۰۲۵
| ویژگی | روشهای سنتی کاشت مو | فناوریهای بازسازی مو با سلولهای بنیادی (۲۰۲۵) |
|---|---|---|
| نوع مداخله | جابهجایی فولیکول از بانک مو به ناحیه طاس | ساخت، احیا و مهندسی فولیکول جدید و نیچ اطراف آن |
| وابستگی به بانک مو | بسیار بالا؛ نیاز به بانک موی کافی | در حال حرکت به سمت کاهش وابستگی به بانک مو (در مرحله پیشبالینی) |
| ظرفیت ایجاد تراکم | محدود به تعداد فولیکولهای موجود در بانک مو | پتانسیل افزایش تراکم از طریق فولیکولسازی (در مدلهای آزمایشگاهی) |
| اثرات بیولوژیک | تغییر محدود در نیچ؛ تمرکز بر جابهجایی | بازسازی نیچ، فعالسازی مسیرهای Wnt/BMP و EMI |
| مناسب برای چه بیمارانی؟ | افراد با بانک موی کافی و الگوی مشخص طاسی | افراد با ریزش منتشر، فولیکولهای ضعیف یا نیاز به تقویت قبل/بعد از کاشت |
| سطح فناوری | بالینی و روتین | در فاز تحقیق و توسعه، اما بسیار نویدبخش |
تعریف سلولهای بنیادی فولیکول مو
«سلول بنیادی فولیکول مو» (Hair Follicle Stem Cells — HFSCs) به آن دسته سلولهایی گفته میشود که توانایی خودتجدید (self-renewal) و تولید سلولهای تخصصیافته برای اجزای مختلف فولیکول مو (ریشه مو، غلاف مو، سلولهای اپیتلیال) را دارند. این سلولها قادر هستند در طی چرخه طبیعی فولیکول (رشد، ریزش، استراحت) مجدداً فولیکول را بازسازی کنند.
سلولهای بنیادین فولیکول در کجای فولیکول مو هستند؟
محل اصلی تمرکز سلولهای بنیادی فولیکول مو در ناحیهای بهنام «Bulge» قرار دارد. Bulge بخشی از Outer Root Sheath (ORS) است. وقتی فولیکول در فاز استراحت (telogen) است، سلولهای بنیادی در Bulge در حالت «کمفعال یا quiescent» هستند؛ اما با شروع فاز رشد جدید (anagen)، فعال میشوند و به سلولهای جدید تبدیل میشوند.
مهندسی فولیکول (Hair follicle neogenesis)، تولید فولیکول نو در آزمایشگاه
هدف مهندسی فولیکول، تولید یک واحد فولیکولی کامل و عملکردی در بیرون بدن (in vitro یا درون میزبان آزمایشی) و سپس پیوند آن به پوست برای رشد موی جدید است. این رویکرد به جای تقویت فولیکولهای موجود، فولیکولهای کاملاً جدید میسازد. تولید واحد فولیکولی کامل از ترکیب سلولهای اپیتلیال پیشساز و سلولهای درمال پاپیلا (یا مشتقات آنها) و سپس پیوند به پوست برای ایجاد موهای جدید، یکی از محورهای کلیدی پژوهشهای پیشبالینی ۲۰۲۳–۲۰۲۵ بوده و نمونههای موفق توسط پروفسور نیلفروشزاده و تیم تحقیقاتی کلینیک نیلفروشزاده در موش در سال ۲۰۱۷ گزارش شدهاند.
سلولهای بنیادی چگونه فولیکولهای ضعیف را احیا میکنند؟ مکانیسمهای اثباتشده بالینی
سلولهای بنیادی مزانشیمی، بهویژه سلولهای مشتق از چربی (ADSC)، از طریق ترشح مجموعهای از فاکتورهای رشد کلیدی مانند VEGF، FGF، IGF-1 و HGF قادرند فولیکولهای ضعیف، خاموش یا وارد فاز تلوژن را دوباره فعال و وارد فاز رشد (آناژن) کنند. شواهد بالینی منتشرشده در PubMed و PMC نشان میدهد که این سلولها از سه مسیر اصلی باعث ترمیم و بازسازی فولیکول میشوند:
۱) تقویت تقسیم سلولی و بازسازی ساختار فولیکولی
فاکتورهای رشد ترشحشده از سلولهای بنیادی، فعالیت کراتینوسیتها و سلولهای پاپیلای درمی (DP) را افزایش میدهند. نتیجه این فرآیند، تحریک سنتز پروتئینهای ضروری فولیکول، افزایش نرخ تقسیم سلولی و تقویت معماری فولیکول است؛ یعنی بازگشت فولیکولهای ضعیف به عملکرد طبیعی.
۲) بهبود خونرسانی و کاهش التهاب محیط فولیکول
سلولهای بنیادی با افزایش میکروسیرکولاسیون پوست و کاهش سیتوکینهای التهابی، محیط فولیکول را به شرایط مناسبتری برای رشد مو تبدیل میکنند. این اثر دوگانه، یعنی افزایش اکسیژن و مواد مغذی و کاهش التهاب، یکی از دلایل اصلی بهبود ضخامت و کیفیت ساقه مو در درمانهای سلولی است.
۳) فعالسازی مسیرهای سیگنالدهی تعیینکننده رشد مو
سلولهای بنیادی با تحریک مسیرهای سلولی Wnt/β-catenin و Shh (Sonic Hedgehog)، فولیکولهای خاموش را بهصورت مستقیم وارد فاز رشد (Anagen) میکنند. این مسیرها مسئول آغاز چرخه فولیکولی، افزایش طول فاز آناژن و جلوگیری از ورود زودهنگام به فاز ریزش هستند.
یافتههای کلیدی پروفسور نیلفروشزاده درباره نقش «نیچ فولیکولی» در بازسازی مو
کاشت مو با سلولهای بنیادی صرفاً به تزریق سلول محدود نیست. همانطور که پروفسور محمدعلی نیلفروشزاده در مقاله مروری خود در سال ۲۰۱۹ نشان دادند، موفقیت واقعی زمانی رخ میدهد که علاوه بر سلول مناسب، محیط اطراف فولیکول، یعنی «نیچ فولیکولی» نیز بازسازی شود.
نیچ فولیکولی (میکرو محیط اطراف فولیکول) در واقع زیستبستر فعال اطراف فولیکول است؛ محیطی شامل:
- سلولهای حمایتکننده مانند درمال پاپیلا (DP)
- سلولهای پیشساز اپیتلیالی
- فاکتورهای رشد طبیعی
- ماتریکس خارجسلولی
این اجزا با تعامل مداوم، شرایطی ایجاد میکنند که فولیکول بتواند وارد فاز رشد (Anagen) شود، ساقه تولید کند و چرخه رشد پایدار داشته باشد.
پژوهشهای پروفسور نیلفروشزاده نشان میدهد که بدون مهندسی این محیط، حتی بهترین سلولهای بنیادی نیز قادر به ساخت فولیکول جدید یا فعالسازی فولیکولهای خفته نخواهند بود. اما زمانی که سلول، فاکتور رشد و بستر زیستی مناسب در کنار هم قرار میگیرند، امکان ایجاد فولیکولهای جدید و احیای فولیکولهای ضعیف بهطور قابل توجهی افزایش مییابد.
این مفهوم، یعنی ترکیب سلول مناسب با محیط حمایتی بهینه، امروز پایه بسیاری از پژوهشهای پیشبالینی و فناوریهای نسل جدید بازسازی مو در جهان است و همچنان یکی از محورهای پژوهشی کلیدی در مطالعات پیشرفته بازساختی محسوب میشود.
سلولهای بنیادی مزانشیمی (MSC) و نقش آنها در بازسازی فولیکول
سلولهای بنیادی مزانشیمی (MSC) از منابعی مانند چربی (برداشت چربی با لیپوساکشن حجم کم انجام میشود؛ یک مداخله سرپایی، بدون نیاز به جراحی بزرگ) یا پوست (در تکنیکهای مرتبط با مو، سلولهای اطراف فولیکول (dermal papilla + sheath) جدا و سپس در محیط کشت تقویت میشوند) بهدست میآیند. چربی یکی از غنیترین منابع MSC در بدن است و نسبت به مغز استخوان یا فولیکول، مزایای بیشتری دارد.
به دلیل چند ویژگی کلیدی، این سلولها گزینهای بسیار مناسب برای تحریک رشد مو هستند:
- استخراج آسان و ایمن: برخلاف سلولهای فولیکولی که نیاز به برداشت فولیکول فعال در کاشت مو دارند، MSC از بافت چربی یا پوست سر قابل دسترسی است و استخراج آن کمتهاجمی است.
- توانایی تقویت فولیکول موجود: MSC میتوانند با ترشح فاکتورهای رشد و سیگنالهای پاراکرینی، فولیکولهای ضعیف یا inactive را فعال کنند.
- پتانسیل بازسازی فولیکول جدید: برخی مطالعات پیشبالینی نشان دادهاند که MSC میتوانند به عنوان منبع سلولی برای تشکیل فولیکول جدید در مدلهای حیوانی عمل کنند.
- قابلیت تکرار در جلسات درمان: از یک برداشت کوچک چربی میتوان چندین بار MSC، SVF یا اگزوزوم تهیه کرد، که برای درمانهای دورهای ریزش مو بسیار ارزشمند است.
قابلیت استخراج کمتهاجمی و ایمن MSC از چربی و پوست سر، این سلولها را به گزینهای ایدهآل برای کاربردهای زیبایی و ترمیمی مانند درمان آلوپسی تبدیل کرده است؛ درحالیکه برداشت سلولهای فولیکولی در کاشت مو محدودتر، پیچیدهتر و وابسته به وجود فولیکولهای سالم میباشد.
ترکیب SVF و PRP، پتانسیل افزایش تراکم و ضخامت مو از نگاه پروفسور نیلفروشزاده
مطالعات بالینی اخیر، از جمله پژوهشهای پروفسور محمدعلی نیلفروشزاده و تیم تحقیقاتی ایشان، نشان دادهاند که ترکیب Stromal Vascular Fraction (SVF) حاوی سلولهای بنیادی مزانشیمی (MSC) با Platelet-Rich Plasma (PRP) میتواند باعث افزایش تعداد موها و ضخامت ساقه مو در بیماران دارای طاسی با الگوی مردانه یا زنانه (Androgenetic Alopecia) شود.
SVF حاوی MSC است که میتوانند با ترشح فاکتورهای رشد و سیگنالهای پاراکرینی، فولیکولهای ضعیف یا غیرفعال را تحریک کرده و محیطی مناسب برای رشد مو ایجاد کنند. از سوی دیگر، PRP غنی از پلاکت و عوامل رشد است که گردش خون و تغذیه فولیکولها را بهبود میبخشد. ترکیب این دو، هم اثر حمایتی فوری PRP و هم اثر ترمیمی و بازسازی سلولی SVF را در فولیکولها به همراه دارد.
در مطالعه ۲۰۲۴ که یک کارآزمایی بالینی تصادفی بود و توسط پروفسور نیلفروشزاده انجام شد، بیماران گروه SVF+PRP نسبت به وضعیت اولیه خود، افزایش قابل توجهی در تراکم مو و قطر ساقه مو را تجربه کردند. این دستاورد نشاندهنده پتانسیل واقعی MSCها در بازسازی یا تقویت فولیکولهای موجود است.
این یافتهها تأکید میکنند که ترکیب SVF+PRP، تحت هدایت پژوهشهای محمدعلی نیلفروشزاده و همکارانش، یک روش نوظهور و امیدوارکننده برای بهبود تراکم و کیفیت مو است، هرچند مطالعات بیشتری برای تعیین پروتکل ایدهآل و اثبات ماندگاری اثرات لازم است.
آیا سلولهای بنیادی و اگزوزومها درمان قطعی طاسی هستند؟
علوم سلولهای بنیادی، اگزوزومتراپی و مهندسی پیشرفته فولیکول مو افق جدید و بسیار امیدوارکنندهای را در درمان ریزش مو گشودهاند؛ تا جایی که بسیاری از فناوریهای نوظهور مانند ارگانوئیدهای فولیکولی، بازسازی نیچ سهبعدی و تحریک مسیر Wnt/β-catenin، توانایی «تولید فولیکولهای جدید» را در مدلهای آزمایشگاهی نشان دادهاند.
با این حال، هیچیک از این فناوریها هنوز به مرحله «درمان قطعی طاسی» در انسان نرسیدهاند. دلیل آن روشن است: مو یک بافت پیچیده با تعاملات اپیتلیال–مزانشیمی، سیگنالینگ چندمرحلهای و وابستگی شدید به نیچ فولیکولی است. بازسازی کامل این ساختارها هنوز چالشهای علمی و بالینی خود را دارد.
بنابراین، بر اساس شواهد معتبر و ادبیات علمی روز، باید این تکنیکها را «فناوریهای نسل آینده» در نظر گرفت؛ راهکارهایی که در مرحله تحقیق و توسعه قرار دارند و طی سالهای آینده میتوانند بخشی از درمانهای بالینی شوند، نه اینکه امروز بهعنوان راهحل نهایی طاسی معرفی شوند.
در نهایت:
- فناوریهای بازسازی مو با سلولهای بنیادی، مهندسی فولیکول و اگزوزومها بسیار نویدبخشاند.
- برخی از آنها توانایی ایجاد فولیکولهای جدید را در مدلهای آزمایشگاهی نشان دادهاند.
- اما هنوز به سطح درمان قطعی طاسی در انسان نرسیدهاند.
- بنابراین باید آنها را «ستون درمانهای آینده» در نظر گرفت، نه درمان قطعی امروز.
سوالات متداول
آیا سلولهای بنیادی میتوانند طاسی را بهطور کامل درمان کنند؟
خیر. درمانهای مبتنی بر سلولهای بنیادی، اگزوزومها و مهندسی فولیکول بسیار امیدبخشاند، اما هنوز به مرحله «درمان قطعی طاسی» در انسان نرسیدهاند. این تکنیکها همچنان در فاز تحقیق و توسعه قرار دارند.
آیا این روشها جایگزین کامل کاشت مو میشوند؟
در حال حاضر هیچ فناوری سلولدرمانی یا مهندسی فولیکول جایگزین قطعی برای کاشت مو نیست. کاشت مو همچنان تنها روش قطعی ایجاد تراکم قابل توجه در ناحیه طاس است. اما فناوریهای وابسته به سلولهای بنیادی میتوانند کیفیت فولیکولها را تقویت کنند، ریزش را کاهش دهند و حتی در آینده بهعنوان مکمل یا جایگزین بخشی از پروتکلهای کاشت استفاده شوند.
تفاوت تزریق سلولهای بنیادی با مهندسی نیچ فولیکولی چیست؟
تزریق سلول تنها بخش کوچکی از ماجراست. موفقیت واقعی زمانی اتفاق میافتد که نیچ فولیکولی، یعنی محیط سهبعدی پشتیبان فولیکول شامل سلولهای DP، سلولهای اپیتلیال و فاکتورهای رشد، بازسازی شود. این نکته کلیدی در مقاله مروری ۲۰۱۹ پروفسور نیلفروشزاده برجسته شده است.
آیا با این روشها میتوان فولیکول جدید ساخت؟
در مدلهای آزمایشگاهی (ارگانوئیدها، مهندسی بافت، فولیکولهای نئودرموس) امکان ایجاد فولیکولهای جدید نشان داده شده است. اما در انسان، هنوز این فناوریها در مرحله پژوهشی قرار دارند و به درمان روتین بالینی تبدیل نشدهاند.
کدام سلولهای بنیادی برای درمان ریزش مو بیشترین اثر را دارند؟
در حال حاضر سلولهای بنیادی مزانشیمی (MSC)، بهویژه سلولهای مشتق از چربی (ADSC) و اگزوزومهای مشتقشان، بیشترین شواهد بالینی را دارند. این سلولها مسیرهای Wnt و Shh را فعال کرده و فولیکولهای ضعیف را وارد فاز رشد میکنند.
چند جلسه درمان سلولی لازم است؟
معمولاً بسته به نوع درمان، بین ۲ تا ۴ جلسه در سال نیاز است. نتایج تدریجی و مرحلهای هستند و به شرایط بیمار، نوع ریزش و سلامت نیچ فولیکولی بستگی دارند.
آیا این درمانها برای آلوپسی آندروژنتیک هم مفیدند؟
بله، بسیاری از این تکنیکها در مطالعات انسانی برای ضخیمسازی مو، کاهش ریزش و افزایش فاز آناژن نتایج امیدوارکنندهای نشان دادهاند، اما همچنان در مرحله «کمکدرمانی» محسوب میشوند، نه درمان قطعی.
آیا این درمانها برای زنان نیز مؤثر است؟
بله. بسیاری از مطالعات نشان دادهاند که درمانهای مبتنی بر MSC، SVF، PRP و فعالسازی مسیرهای Wnt و Shh در زنان مبتلا به آلوپسی آندروژنتیک یا ریزش منتشر، نتایج قابل قبولی داشتهاند. با این حال، پاسخ درمانی وابسته به علت ریزش، وضعیت هورمونی، بیماریهای همراه و سلامت نیچ فولیکولی است و نیاز به ارزیابی تخصصی دارد.